Une équipe américaine menée par le Dr Kamel Khalili (Lewis Katz School of Medecine of Temple University) a réussi à éliminer le génome du virus simien de l’immunodéficience (SIV) intégré au génome de primates infectés, en utilisant la technologie CRISPR/Cas9. Ces données, publiées dans Nature Communication, offrent la preuve de concept de la possibilité de se défaire du génome viral intégré. Elles ouvrent la voie vers de nouvelles perspectives dans la recherche de thérapie en vue d’une guérison.
Eliminer le génome viral intégré reste le grand défi auquel les chercheurs sont confrontés pour éradiquer les réservoirs viraux de l’organisme et enfin pouvoir guérir du VIH. Il semblerait que le Dr Khalili et son équipe soient sur la bonne voie d’après leurs résultats récemment publiés [i]. En adaptant la technologie CRISPR/Cas9 (encart), également connue sous le nom de ciseaux moléculaires, ils ont pu cibler et éliminer le génome du virus SIV chez des primates non-humains. Leurs précédents travaux menés sur des modèles murins avaient déjà réussi à prouver que leur système pouvait éliminer l’ADN du VIH dans les cellules et les tissus [ii].
Dans cette nouvelle étude, ils ont cherché à savoir si la technologie CRISPR/Cas9 spécifiquement dirigée contre le génome viral, permettrait d’éliminer in vivo les provirus intégrés au génome des cellules. Pour cela ils ont utilisé un modèle d’infection SIV chez des primates non humains placés sous traitement antirétroviral. En parallèle, ils ont adapté le CRISPR/Cas9, en utilisant un ARN guide spécifique d’une partie du génome viral, afin qu’il puisse reconnaitre spécifiquement le génome du virus SIV. Pour livrer le CRISPR/Cas9 au sein des cellules, ils ont utilisé un vecteur adénoviral (AAV). L’ensemble de la construction forme une sorte de coque (vecteur adénoviral) renfermant le CRISPR/Cas9. L’efficacité de la construction à éliminer de manière spécifique le génome du virus intégré sans causer de dommage au niveau cellulaire a été validée in vitro avant le passage en modèle animal.
Au cours des expérimentations, trois primates ont reçu une injection intraveineuse de la construction AAV-CRISPR/Cas9. Trois semaines après injection, l’analyse de la bio-distribution du composé a indiqué que la construction est retrouvée dans une multitude de tissus dont la moelle osseuse et épinière, les poumons, le cerveau, la rate, les ganglions, les intestins. A l’échelle de la cellule, les chercheurs ont également retrouvé la construction au sein des lymphocytes T CD4, la cible principale du virus. Il ne restait alors plus qu’à s’assurer que le CRISPR/Cas9 présent dans les tissus pouvait éliminer de manière sécurisante les génomes viraux intégrés. Les analyses ont montré que l’excision de l’ADN viral intégré a fonctionné, avec un taux d’efficacité allant de 37 à 92 % dans les cellules du sang et entre 38 et 95 % dans les ganglions.
Dans cette étude, les auteurs ont prouvé que l’injection intraveineuse, chez le primate non-humain, d’un vecteur adénoviral contenant un CRISPR/Cas9 spécifique au génome SIV est bien toléré, bien distribué dans tout l’organisme et notamment dans les tissus et cellules qui composent le réservoir viral. De plus, le CRISPR/Cas9 est capable d’exciser les génomes viraux dans ces cellules, sans entrainer de dommage au génome cellulaire. Ces résultats sont encourageants mais comme les auteurs l’indiquent ils doivent être confirmés à plus grande échelle et sur des temps plus longs avant de pouvoir passer à des essais cliniques chez l’homme.
Ces travaux semblent prometteurs et pourraient, s’ils sont confirmés dans des études chez l’homme, apporter une solution thérapeutique pour éliminer le réservoir. Mais certaines questions émergent. Est-on réellement sûr que l’intégralité du réservoir viral pourra être éliminé ? Cette technologie soulève également des questions éthiques, notamment sur la manipulation du génome.
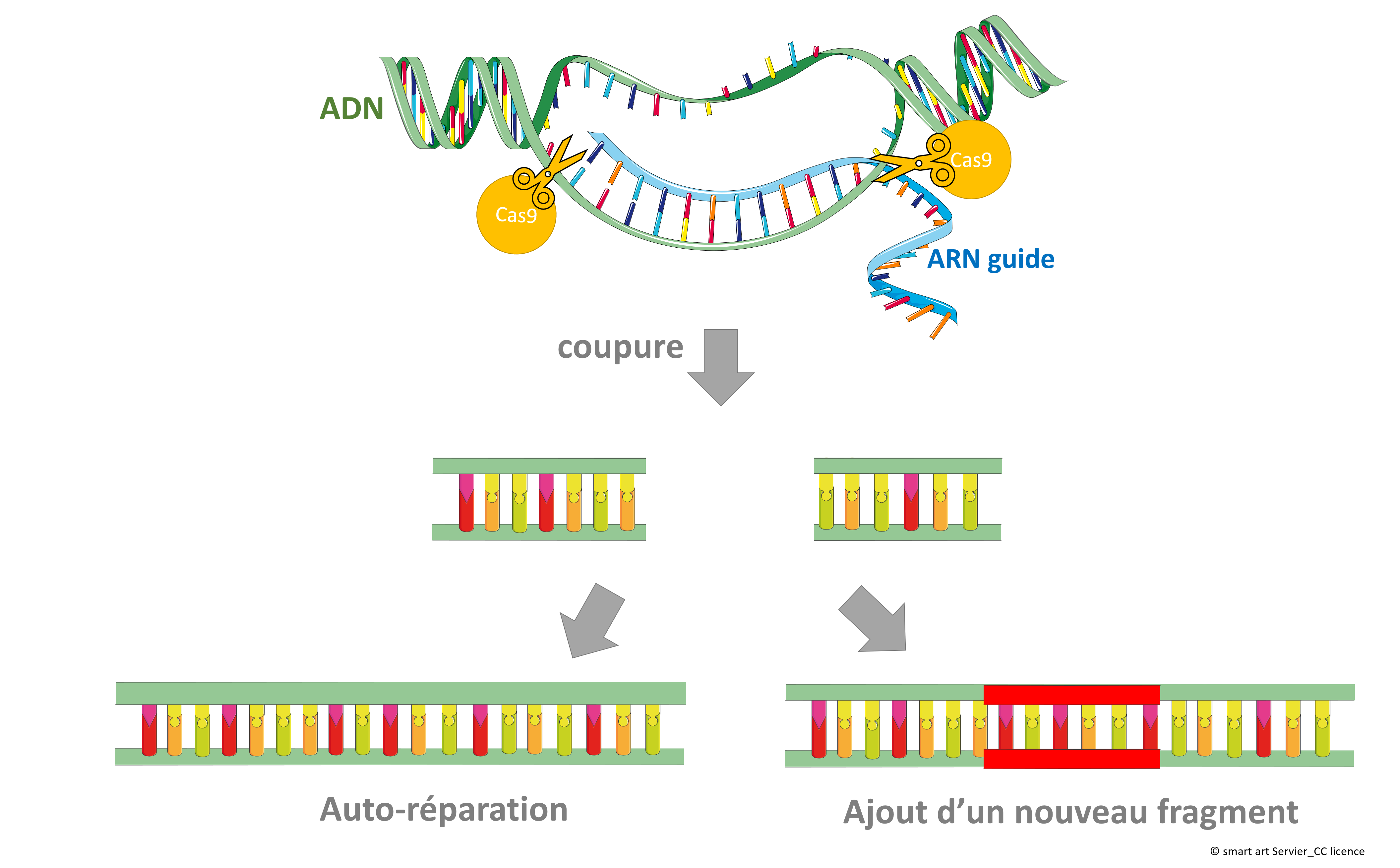
La technologie CRISPR/Cas9 est un outil de modification du génome des organismes vivants. Cet outil est une adaptation d’un système naturel de modification du génome chez les bactéries. Les chercheuses Jennifer Doudna et Emmanuelle Charpentier, ont reçu en 2020 le prix Nobel de chimie pour le développement de cet outil rapide, peu onéreux, plus précis et plus efficace que les autres méthodes d’édition existantes. Les expériences menées par les deux femmes ont permis de développer ces ciseaux moléculaires capables de couper n’importe quelle molécule d’ADN à un site prédéterminé. Le système se compose d’un ARN guide (CRISPR) correspondant à la séquence ADN qui doit être éliminée et d’une enzyme Cas9 qui coupera les brins aux endroits indiqués. Une fois le morceau d’ADN d’intérêt éliminé, on peut soit laisser l’ADN s’autoréparer ou bien y insérer un nouveau morceau d’ADN.
 Les
ciseaux moléculaires CRISPR/Cas9, nouvel horizon du « Cure » ?
Les
ciseaux moléculaires CRISPR/Cas9, nouvel horizon du « Cure » ? 





