Deux équipes de recherche américaines ont récemment publié leurs travaux portant sur des approches de réactivation des réservoirs viraux VIH, dans la prestigieuse revue Nature. Utilisant des approches différentes dans deux modèles animaux, les équipes arrivent à réactiver les virus latents présents dans le sang et différents organes. Ces résultats, bien que préliminaires, pourraient faire avancer les recherches sur la compréhension des mécanismes de persistance, qui reste l’obstacle majeur entravant la voie vers l’éradication du virus et la guérison.
Aujourd’hui, une bonne observance dans la prise du traitement antirétroviral (ARV) permet aux personnes vivant avec le VIH (PvVIH) d’avoir une charge virale indétectable et de ne pas transmettre le virus. Pour autant le virus n’est pas complètement éliminé de l’organisme. Une partie persiste sous forme latente dans des cellules immunitaires, constituant le réservoir viral. Ces cellules dormantes portent dans leur génome l’ADN viral (ou provirus) mais ne produisent pas de virus. Cette spécificité leur confère une insensibilité aux traitements ARV actuels. Le moindre changement entrainant une réactivation de ces cellules (ex : arrêt des ARVs) va induire le « réveil » des provirus et la production de nouveaux virus. C’est sur cette base que la stratégie « shock & kill » a été développée. Ce procédé consiste à « réveiller » les provirus latents afin qu’ils produisent à nouveau des virus, qui seront par la suite « éliminer » par le système immunitaire et les ARVs.
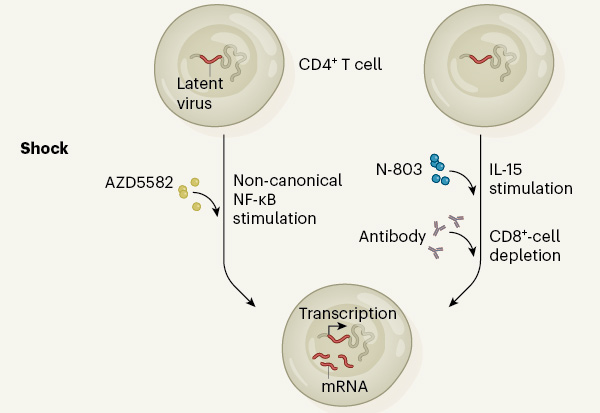
Comment réveiller ces virus latents ?
En agissant au niveau de la transcription des gènes. La transcription est la première étape du processus de synthèse des protéines essentielles au développement et au fonctionnement des cellules. Ce passage de l’ADN en ARN est hautement régulé par différents facteurs cellulaires. Parmi eux, le facteur de transcription NF-kB régule l’expression de nombreux gènes impliqués dans la réponse immunitaire et la réponse au stress cellulaire. L’ADN viral étant intégré au génome cellulaire, ce facteur est également impliqué dans la transcription virale. NF-kB régule la balance fine existant entre maintien sous forme latente et réactivation du VIH[i]. Au niveau cellulaire ce facteur contribue à assurer la survie des lymphocytes T lors de leur différentiation en cellules mémoires. Dans le cadre d’une infection VIH, une signalisation NF-κB prolongée peut entraver l’établissement du réservoir en raison de ses effets activateurs sur le génome du virus. Le niveau d’expression de NF-kB dans la cellule infectée peut donc influer sur la probabilité de la mise en place d’une infection latente.
Le procédé utilisé par Christopher Nixon[ii] et ses collègues porte sur l’utilisation de la molécule AZD5582 qui est capable d’activer NF-kB. Les chercheurs ont testé son effet sur la réactivation des gènes viraux latents dans deux modèles animaux de référence dans la recherche sur le VIH : les souris humanisées et les macaques rhésus. Le choix s’est porté sur cette drogue, développée pour des études en cancérologie, de part son mécanisme d’action particulier. La molécule AZD5582 cible une voie alterne d’activation de Nf-kB qui permet d’induire une transcription des gènes progressive mais persistante. Chez les souris et les macaques, l’utilisation de la molécule AZD5582 entraîne une production d’ARN viral dans le sang et les lymphocytes T CD4 des organes lymphoïdes, révélant donc une inversion de la latence. Les auteurs indiquent tout de même ne pas observer de réduction de la taille du réservoir viral chez les animaux, malgré la réactivation de la latence.
Dans la seconde étude menée par Julia Bergild McBrien[iii], l’équipe a opté pour une approche combinée, centrée sur deux composants immuns : les lymphocytes T CD8 et l’interleukine IL-15. Les lymphocytes T CD8 contribuent, avec les ARVs, au contrôle de la multiplication virale[iv]. Quant à l’IL-15, elle active certaines cellules immunitaires pour combattre les pathogènes. L’IL 15 a également été identifié comme agent révertant de latence (expériences menées in vitro)[v]. La stratégie utilisée ici consiste à éliminer les lymphocytes T CD8 et booster l’effet de l’IL-15. Pour cela les chercheurs ont utilisé deux agents : l’anticorps MT807R1 pour la déplétion des cellules CD8 et la protéine modifiée N-803, qui est une version plus puissante que l’IL-15 naturelle. Dans leur modèle de macaques infectés par le VIH et traités, les chercheurs ont testé l’effet combiné ou seul des composés sur l’inversion de la latence. La déplétion des cellules CD8 entraîne une augmentation de la charge virale dans le sang. L’utilisation du composé N-803 in vivo n’induit aucun effet sur la réactivation du réservoir, à la différence des données obtenues in vitro. La combinaison des deux agents permet d’augmenter de manière importante le taux d’ARN viral. Les auteurs ont reproduit ces résultats dans un modèle de souris humanisées. Ces travaux ont aussi montré l’effet inhibiteur des lymphocytes T CD8 sur l’activité de la molécule N-803 dans des expérimentations in vitro. Ces derniers résultats suggèrent un potentiel rôle des lymphocytes T CD8 dans le maintien de la latence, en tout cas chez les primates.
Que conclure de ces deux études ?
Que les résultats doivent être pris avec un peu de recul. Les stratégies employées ici ne sont pas encore transposables à l’homme. Certes les molécules utilisées n’entraînent pas d’effets indésirables sévères chez les animaux, mais ils devront passer des tests plus rigoureux avant de pouvoir être utilisés dans des essais cliniques chez l’homme. De même, une stratégie impliquant l’élimination des cellules T CD8 n’est pas applicable chez l’homme, du fait de l’importance de ces cellules dans la défense de l’organisme. Enfin, bien que les effets de ces stratégies à « réveiller » les virus aient été prouvés, la question de l’élimination des cellules et des virus activés n’est pas démontrée dans ces études. De nombreuses molécules ont déjà été testés dans le cadre de la stratégie « shock & kill », mais elles semblent avoir du mal à passer le cap de la preuve de concept. On retient en effet que le passage de cette stratégie chez l’homme (essai RIVER) n’a pas donnée les résultats escomptés. Néanmoins ces études ont le mérite d’apporter de nouvelles perspectives dans la recherche d’agents capable d’inverser la latence virale. Elles permettent également d’ouvrir de nouvelles pistes et d’avancer dans la compréhension des mécanismes cellulaires impliqués dans la latence virale, notamment le rôle que pourraient jouer les lymphocytes T CD8.
 Un réveil de « shock » pour les virus en sommeil
Un réveil de « shock » pour les virus en sommeil